我們知道流式實驗中
抗體標記的數量越多得到的信息就越詳細和準確,以此同時,實驗操作也變得更加復雜。多色流式實驗中的補償操作,一直以來都是流式使用者非常關心的問題。甚至有人認為,由于目前熒光染料的光譜普遍比較寬,可能會在相鄰的多個通道都造成比較大的干擾,因此很難在流式上完成超過 18 色以上的實驗。事實是否真是這樣呢?恰巧哈佛醫學院附屬麻省總醫院的 Dr. Ravi Mylvaganam 與我們分享了他在 6 激光 21 色的 CytoFLEX LX 上做的一個多色實驗。我們一起來看看。
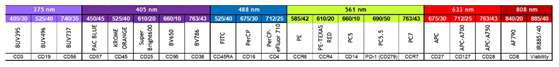
Dr. Ravi Mylvaganam 采用 20 個熒光抗體以及一個
細胞死活染料組成 21 色的 panel,可同時檢測多群記憶、效應 T 細胞,調節性 T 細胞,NK 細胞甚至是干細胞樣 T 細胞等細胞亞群,詳細的抗體和染料標記如下所示:
實驗樣本準備步驟:
1. 標記一個樣本管,在管中添加 3 µL 以下抗體:
1) CD3 BUV395
2) CD19 BUV496
3) CD56 BUV737
4) CD25 BV605
5) CD95 BV650
6) CD38 BV786
7) CD16 PerCP
8) CD4 PerCP-eFluor710
9) CCR4 PE-TexasRed
10) CCR7 PC7
11) CD8 AF790
2. 添加 25 µL Brilliant Stain Buffer,渦旋混勻 4 秒;然后加入 100 µL 全血,再次渦旋混勻 4 秒后,在 37ºC 下避光孵育 20 分鐘
3. 在試管中添加 5 µL 以下抗體:
1) CD57 Pacific Blue
2) CD45 Krome Orange
3) CD45 RA FITC
4) CCR6 PE
5) CD14 PC5
6) PD-1 (CD279) PC5.5
7) CD27 APC
8) CD127 APC-A700
9) CD28 APC-A750
4. 渦旋混合試管 4 秒后室溫避光孵育 20 分鐘
5. 在管中添加 1 mL VersaLyse 裂解液,渦旋混合 2~3 秒,室溫下避光孵育 15 分鐘
6 樣本 200 g 離心 5 分鐘,棄去上清液
7. 在試管中添加 5 µL IR Fixable 染料,渦旋混合 2~3 秒,室溫下避光孵育 20 分鐘
8. 添加 2 mL PBS 重懸細胞,200 g 離心處理試管 5 分鐘,棄去上清液
9. 添加 0.9 ml PBS 和 0.1 ml IOTest3 固定液重懸細胞,可準備上機檢測
10. 同時按照上述的孵育、離心操作制備單染管
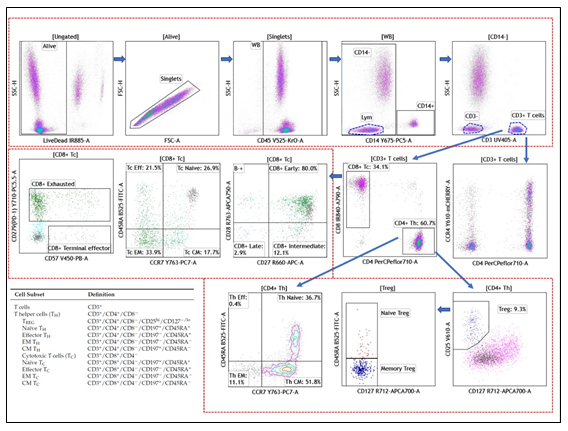
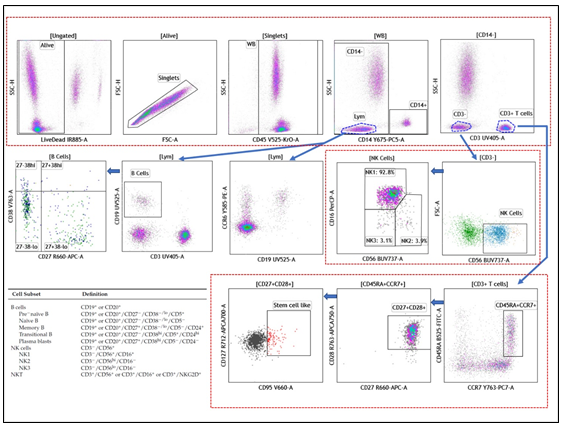
實驗結果如下
從實驗結果圖可以看出,這個 21 色方案的結果分群清晰,不論是常規的 CD3+CD4+Th 細胞還是含量較低的 Treg 或者干細胞樣 T 細胞,都能很好的檢測到,看來對于 CytoFLEX LX 而言,21 色實驗也不是一個難題。如果您需要該方案詳細的信息,可與我們聯系。
多色補償問題的簡化,與流式細胞儀技術的發展密切相關。遙想小編當年,那個流式細胞儀用完后還要用紅布蓋起來的年代,我剛開始接觸的是一臺 4 色的流式,當時 4 色實驗就是「多色」實驗了!那時沒有離線補償也沒有自動補償,流式也沒做得那么頻繁,調補償是相當刺激的操作:先在 17 寸顯示屏上畫滿所有通道兩兩對應的散點圖,上樣之后一定要眼疾手快反應迅速默念「橫平豎直」,如果相關的門沒圈好,或者看到補償矩陣腦子蒙圈不知道調哪里,一著急就手足無措,經常一管單染管跑完補償還沒調好所以實驗前師兄師姐往往要提醒「單染管多準備點樣本」……
原創作者:上海遠慕生物科技有限公司